据储能界了解到,
摘要:锂离子电池(LIB)应用领域广泛,但其在低温条件下容量、倍率和寿命等指标严重下降,极大限制了LIB在低温领域的应用。造成LIB低温性能差的因素有很多,其中发生在电极/电解质界面附近的微观过程,特别是低温下固态电解质界面(SEI)附近锂离子(Li+)脱溶剂化能垒增大以及Li+通过SEI的缓慢传输对LIB的低温性能起着决定性作用。因此,低温电解液的改进与发展对低温LIB的进一步应用具有重要意义。从限制低温LIB动力学的因素着手,分析其低温速控步骤,并探讨了溶剂、盐、添加剂在不同电池体系中改善低温性能的机制和规律,期望从电解液设计的角度为下一代低温LIB的研究提供借鉴。
关键词:锂离子电池;低温;速控步骤;电解液设计;电极/电解质界面
锂离子电池(LIB)具有能量密度高、循环寿命长、加工工艺成熟等特点,经过近三十年的高速发展,已经成功应用于电子设备、新能源汽车、储能基站、航天及军事装备等领域[1]。尽管如此,在一些特殊环境,如极低温下,LIB的应用依然受限[2]。如图1(a)所示,对于典型的LIB,在−40 ℃下已经难以正常充放电,无法应用于现实低温储能场景[3]。
低温下石墨负极内部的Li+扩散速率随温度变化非常大,当温度降至−40 ℃时,Li+在石墨负极内的扩散系数约为10−11 cm2/s,[4]这导致在低温快速充电过程中Li+难以嵌入石墨内部而是在负极表面镀锂,从而引发枝晶生长导致安全问题[5-6]。同样,Li+在正极材料中的扩散系数也会因为低温动力学反应受限显著降低,进而影响其低温性能[7-8]。
除电极材料外,电解液对LIB低温性能的影响也不可忽视。电解液不仅流动性、浸润性、离子电导率等自身因素受温度影响较大,其与电极反应生成的固体电解质相(SEI)对温度的变化也十分敏感。当温度降低时,大多数基于碳酸盐电解液的商用LIB由于离子电导率显著降低、Li+在SEI处脱溶困难以及在SEI中输运缓慢等问题,使得Li+在负极-SEI界面耗尽最终导致严重的容量损失以及充电困难[3]。不仅如此,Li+在电解液中的溶剂化以及SEI的化学成分都与电解液溶剂以及锂盐息息相关。因此,在掌握溶液化学理论的基础上对电解液进行理性设计是改善LIB低温性能的关键。
根据LIB的结构及成分,将制约其低温性能的因素归结为以下几点:(1)本征晶界电阻的增大和电极内Li+扩散缓慢,抑制了嵌锂/脱锂反应速率;(2)在低温下负极严重镀锂导致枝晶生长和死锂产生,降低了电池循环效率;(3)Li+脱溶困难、在SEI中传输缓慢以及电荷转移电阻较大等,降低了电池动力学;(4)液体电解质粘度增加甚至低温凝固导致电导率和扩散速率下降,阻碍了离子在电解质中的输运[图1(b)]。
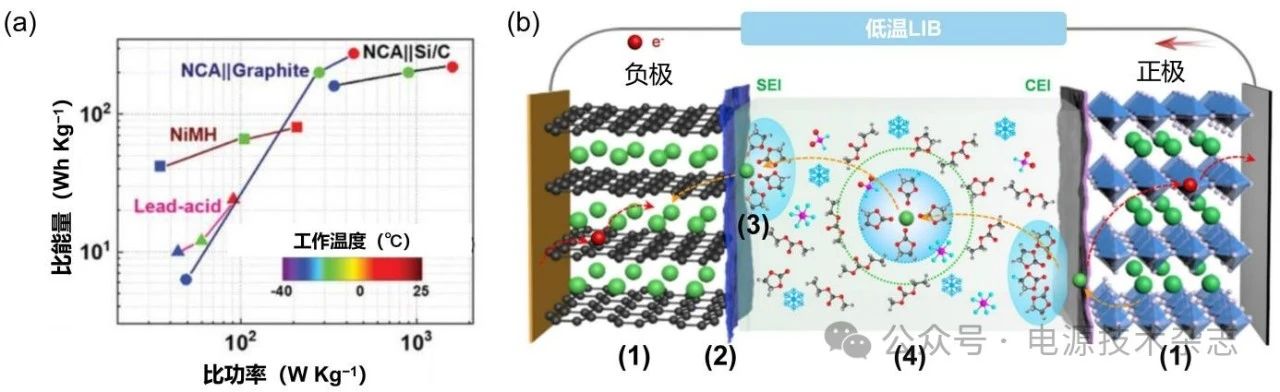
图1 (a) 25、−20、−30 C下典型商用电池的能量/功率密度[3];(b)由层状氧化物正极、石墨负极和电解质组成的LIB示意图以及低温操作的限制因素[9]
本文首先从电极、电解液以及电极/电解液界面角度分别论述了多个限制LIB低温性能的动力学因素,进而探讨并指出了低温下限制电池性能的关键速控步骤,最后对影响电池低温性能的关键因素电解液进行综述,着重介绍了近年来低温电解液相关工作的研究进展。
1 限制LIB低温性能的关键步骤
LIB的能量密度和功率密度在低温条件下衰减严重。宏观上表现为随着温度降低,LIB的阻抗增大,放电平台电压降低,电池端电压下降较快。此外,LIB在低温下阻抗增加,导致充电电压迅速上升,达到充电截止电压时间缩短,电压平台锐减,电池在低温下充电困难且效率较低。
从微观上看,一方面是电极的限制,低温使得正负极内部的Li+扩散速度减慢,阻碍嵌(脱)锂过程[图1(b)步骤1]。也有不少科研工作者对此展开了大量的研究。Huang等[4]将低温性能的差异归因于石墨中Li+的扩散速率,Li+在石墨中的扩散速率为10−11 cm2/s,而焦炭中为10−9 cm2/s。通过频率域阻抗分析和恒流间歇滴定技术,Wang等[10]揭示了在石墨锂化过程中电池极化较大,导致Li+插入石墨的过程受限,−30 ℃时电池容量较低。对于上述问题,可以通过表面改性和表面涂层,杂原子掺杂(如纳米金属颗粒Cu, Al, Sn)和减小颗粒尺寸等方法来改善正极和负极材料体相中Li+的扩散。
另一方面,低温使得LIB的过电压增大。Li+嵌入石墨的电位与锂离子镀锂电位接近(在100 mV vs. Li/Li+范围内),一旦过电势超过这一限度,Li+会倾向于在石墨表面沉积,而不是嵌入石墨层中[图1(b)步骤2]。这种行为极易引发枝晶生长,带来严重的安全隐患。Ge等[5]通过核磁共振波谱法分析了石墨||LiNi1/3Co1/3Mn1/3O2 (NCM111)电池在不同SOC(荷电状态)和温度下的镀锂情况。结果表明,在−20 ℃/1.5 C条件下,即使SOC含量低于10%,也能发生镀锂现象。对于石墨低温镀锂的问题,通过调控石墨体相中Li+的扩散速率以及SEI成分可以很大程度上得到抑制。
电极材料的限制使得LIB的低温性能有所降低,但是电极上所发生的步骤2、4并不是低温电池性能的决定性因素。这是因为电解液中的Li+扩散系数随温度降低而降低的程度远远大于电极内部,且改善电解液中的溶剂化结构及脱溶动力学也能调节离子在电极中脱嵌行为,从而有效防止Li+在电极表面沉积,达到降低电池低温过电势、调控SEI、抑制锂沉积的效果。因此优化电解液是改善电池低温性能最为经济、简单且成效显著的途径。
要想合理设计低温电解液,就要了解电解液与电池低温性能之间的构效关系。电解液对LIB低温性能的影响主要表现为以下几个方面:
(1)正负极之间:随着温度降低,电解液的粘度增加甚至冻结,导致离子电导率急剧下降,Li+在正负极之间的迁移被抑制,扩散速度缓慢[图1(b)步骤4]。LIB常用的商业碳酸盐电解液熔点较高(如EC/DMC,体积比 1:1,摩尔熔点≈10 ℃),在低温下会直接冻结[11]。优化电解液溶剂组成可以有效降低低温下电解液的粘度和熔点,这也是设计低温电解液的原则之一。然而低温下,相较于SEI以及电荷转移电阻的增幅,电解液电阻的增加几乎可以忽略不计。因此,液相运输限制不是影响LIB低温性能的关键。
(2)电极/电解质界面:低温下Li+脱溶能垒增加,SEI表面的Li+浓度降低,低温下SEI阻抗及电荷转移阻抗剧增导致Li+在SEI中的扩散更加缓慢,严重限制了LIB的低温性能[图1(b)步骤3]。而低温下正极阻抗几乎没有变化。因此,影响LIB低温性能的关键步骤是负极/电解液界面附近Li+浓度以及SEI成分的变化。其中,在电极/电解液界面发生的步骤39图1(b)又可详细分为Li+脱溶及Li+在SEI中扩散(如图2)[12]。
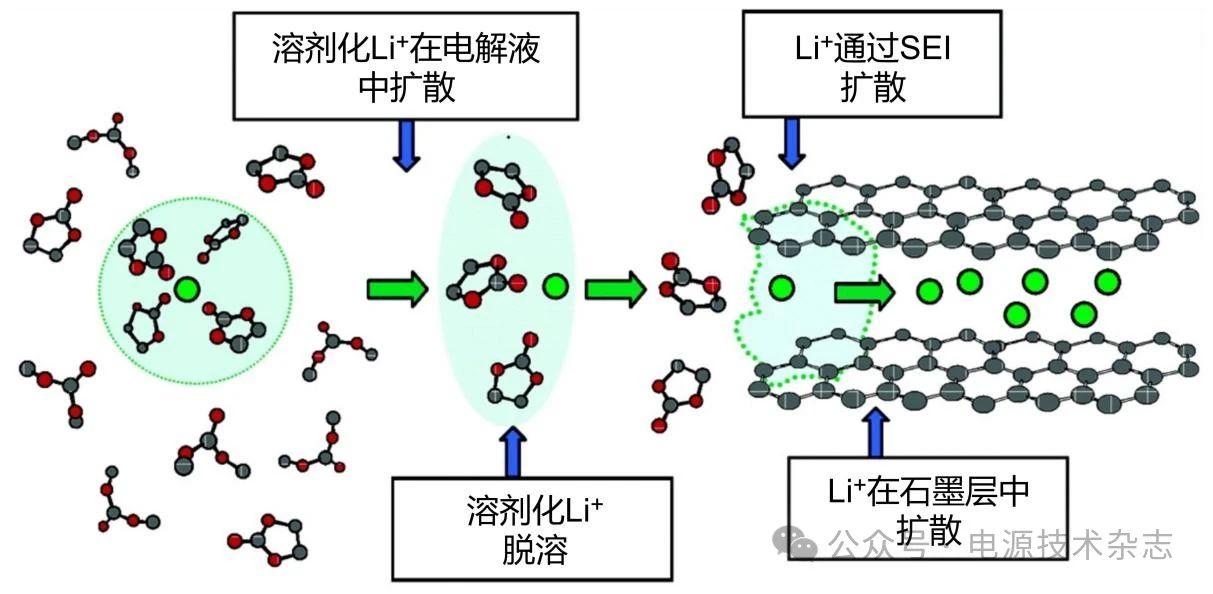
图2 Li+从电解质进入石墨层的示意图(电极/电解液界面附近发生的步骤包括Li+在SEI表面脱溶和Li+通过SEI迁移[12])
Hess[13]将SEI过电位的非线性研究扩展到宽温度范围,发现Li+通过SEI的传导机制表现出明显的温度依赖性。Li+在SEI中的扩散系数和传输阻力随温度降低也发生明显变化。低温下SEI与负极表面的锂沉积行为息息相关,SEI中增大的Li+传输阻力以及SEI本身的不均匀性都会导致Li+的消耗以及锂枝晶的生长。
Li+脱溶也是LIB低温性能的一大限制因素,在低温下Li+的脱溶能垒显著增加。然而,低温下的速率控制步骤究竟是这两步中的哪一步?有研究者通过巧妙的研究方法给出了答案。Li等[14]通过Li4Ti5O12(LTO)材料组成的LTO||LTO对称电池排除了SEI电阻的干扰,揭示了低温下的速控步骤是Li+脱溶而不是Li+通过SEI或在电极材料中扩散。具有较高插层电位的LTO负极通常被认为处于碳酸盐基电解质的电化学窗口内,电解质不会在LTO负极表面发生还原反应,不存在SEI形成过程,可以排除SEI对电池的影响。因此,LTO||LTO电池是检测低温Li+脱溶的理想模型电池。测量包括LTO||LTO在内的三种对称电池在低温下的阻抗,显示阻抗大小未有明显区别[图3(a)],这表明低温下Li+通过SEI的迁移不是LIB低温性能的决定步骤。更换LTO||LTO对称电池电解质再次测量阻抗,发现不同电解质由于溶剂化结构差异而表现出区别显著的电荷转移电阻Rct[图3(b)]。结合这两个实验可知,低温脱溶剂化确实对LIB电荷转移电阻Rct的迅速增加起着关键作用,是调控LIB低温性能的关键步骤。
综上所述电解液作为LIB的“血液”在正负极间传输Li+、SEI构建及调控锂沉积上起着至关重要的作用。负极/电解液界面处发生的微观过程更是对LIB的低温性能起关键性影响。确切来说,Li+在SEI表面的脱溶过程是限制LIB低温应用的决定性步骤。
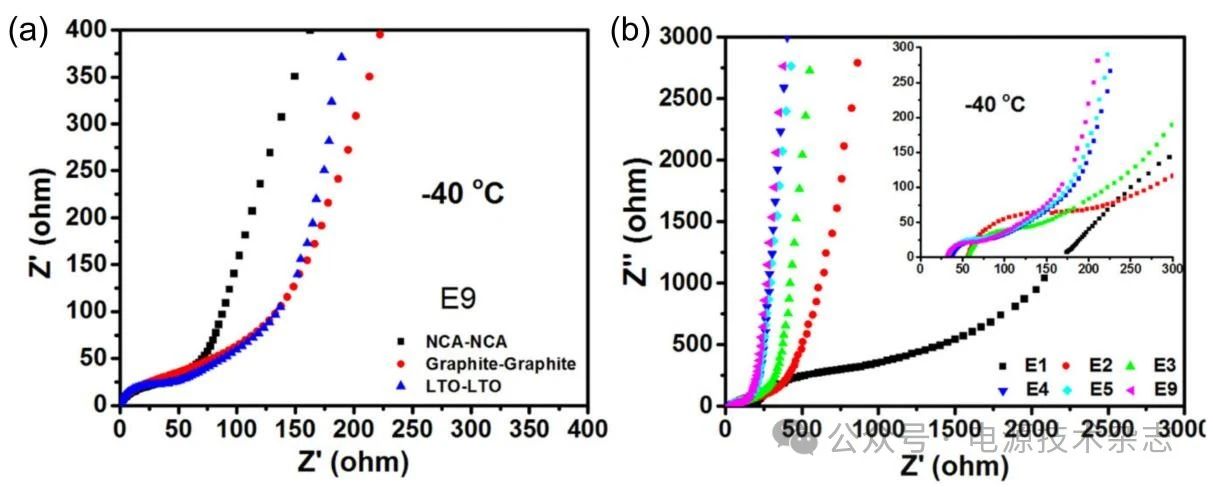
图3 −40 ℃下的EIS,(a)三种对称电池(NCA||NCA、石墨||石墨、LTO||LTO);(b)不同电解液的LTO||LTO对称电池[14]
2 低温电解液的改进
电解液对LIB低温性能的改善至关重要,为了保证LIB在低温下的电化学性能,设计的电解液应满足以下要求:(1)在较宽的温度区间内保持液体状态;(2)在低温下保持相对较高的离子电导率(至少0.1 mS/cm);(3)在整个工作温度区间内形成稳定的电极/电解质界面(SEI和CEI),且界面电阻较低。
常用的电解液通常包括溶剂、锂盐和添加剂,因此对电解液低温性能的改善理应从以上三方面着手。本文接下来重点综述了近年来低温电解液在以上三个方向的主要进展。
2.1 有机溶剂
2.1.1 碳酸酯溶剂
具有高介电常数(ε,25 ℃时为89.78)和良好的石墨负极钝化能力的碳酸乙烯酯(EC)一直以来被认为是锂离子电池电解液不可或缺的组成部分,但是由于其熔点较高(36.4 ℃),常温下就已经凝固,所以常和其他碳酸酯类溶剂搭配使用,如碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)、碳酸二乙酯(DEC),合理搭配可有效降低电解质的粘度,改善电解液整体离子运输动力学。图4(a~c)显示了常用碳酸酯溶剂在熔点、粘度(η)、介电常数(ɛ)以及结构方面的差异[9]。
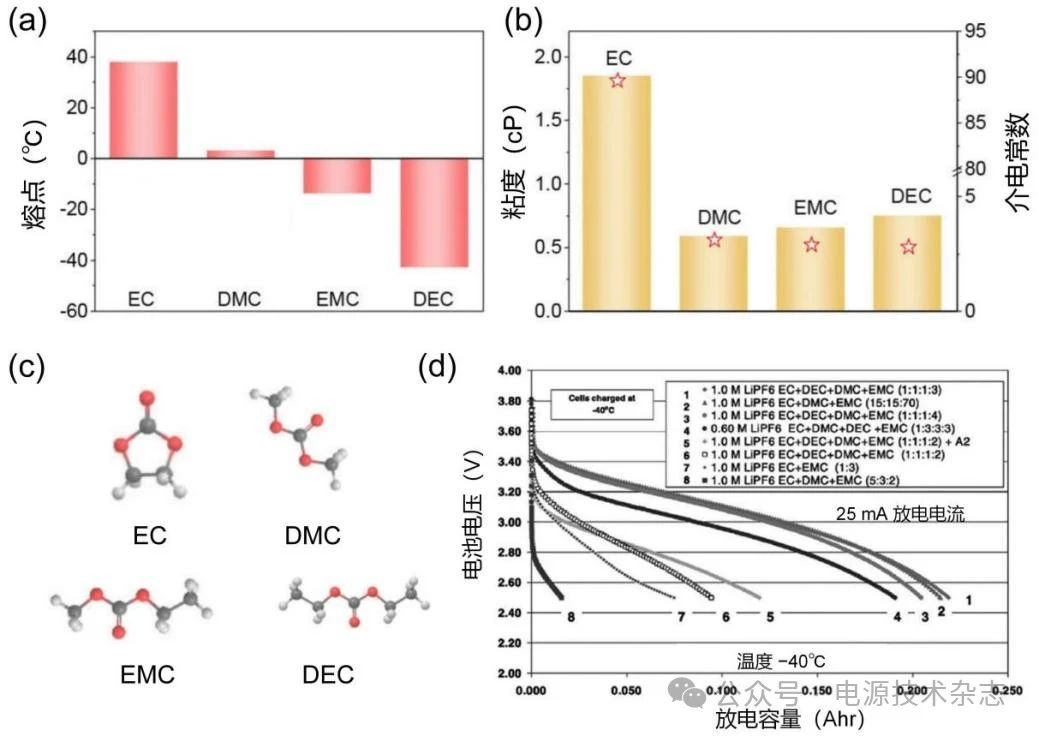
图4 不同碳酸酯溶剂的(a)熔点;(b)粘度和介电常数;(c)分子结构;(d)不同溶剂比例的二元、三元和四元碳酸酯电解液组成的MCMB /LiNi0.8Co0.2O2电池,在−40 ℃时的放电电压分布[9, 15]
通常情况下,EC在低温电解液中的质量分数不宜超过30%,低用量的EC有利于在保持电解液低熔点的同时形成良好的SEI以稳定电极,从而获得良好低温性能。Smart等[16]的研究发现,含有1 mol/L LiPF6的EC、DEC、DMC等比例三元混合物在−40 ℃时的电导率约为1 mS/cm,比EC/DMC或EC/DEC的简单二元混合物高出约10%,更有助于在低温下嵌入(脱嵌)锂。进一步测量了1.0 mol/L LiPF6在一系列二元和三元纯碳酸盐溶剂混合物中的离子电导率。结果表明,由于三元电解质的协同作用,在所有温度下都表现出最高的电导率。此外,除电导率的变化,不同比例的多组分溶剂体系还会在形成SEI的过程中发挥不同作用,从而形成综合性能好的SEI。加入少量EMC可以降低EC/DMC混合物的凝固点,有利于拓宽电解液的应用温度范围。Smart在三元体系[15]中加入了EMC,继续深入探索四元碳酸酯溶剂体系的低温性能,其中最优配方包括1.0 mol/L LiPF6 EC/DEC/DMC/EMC(体积比1∶1∶1∶2)和1.0 mol/L LiPF6 EC/DEC/DMC/EMC(体积比1∶1∶1∶3)[图4(d)],最后总结溶剂在负极上形成离子导电和保护表面膜的相对能力:ECDMCEMCDEC,在四元体系中EC和DMC用于构建出理想的SEI,EMC和DEC则可以降低电解液熔点以及提高低温下的导电性。实际结果与设想一致,该四元体系在−40 ℃时分别提供1.21和1.32 mS/cm的高离子电导率和最突出地放电容量。
此外,除了上述四种常用碳酸酯溶剂外,碳酸丙烯酯(PC)作为石墨的共插层溶剂,低熔点能够抑制EC结晶,也是很好的低温电解液组分。在电解液中加入PC,通过合理调配电解液配方(EC/PC/EMC/DEC vs. EC/PC/EMC/DMC/DEC等)和溶剂比例(EC/PC/EMC/DMC, 1.8/0.3/3.0/3.5 vs. 1.0/0.25/3.0/0.3等)[17],电池能够在−20 ℃、C/5条件下提供94%的室温容量。统计结果表明,当混合溶剂中环状碳酸盐含量超过40%时,低温放电能力将受到影响。因此,在电解液中加入EC或PC等环状碳酸酯时用量也是重要的考量因素。
纯碳酸酯溶剂目前的主流设计思路就是增加溶剂种类,调配溶剂比例,以此来最大限度地发挥多种溶剂的协同作用,在增高LIB低温离子导率的同时构建有助于循环稳定性的界面层。
2.1.2 羧酸酯溶剂
羧酸酯溶剂的熔点和粘度要低于碳酸脂溶剂,如甲酸甲酯(MF,熔点:−100 ℃)、乙酸甲酯(MA,−98 ℃)、丁酸甲酯(MB,−84 ℃)、乙酸乙酯(EA,−84 ℃)、丙酸乙酯(EP,−73 ℃)等。然而羧酸酯溶剂易分解,单独使用效果不佳,所以常用羧酸酯溶剂来替换多元碳酸盐体系中的一个或多个碳酸脂溶剂形成碳酸酯和羧酸酯混合电解液体系。
如图5是几种常用羧酸酯的熔点、粘度(η)、介电常数(ɛ)和分子结构[9]。由于低凝固点和高极性,Ein-Eli等首次将羧酸酯溶剂MF引入EC基电解质中,1.0 mol/L LiAsF6在MF/EC(1/1)、MF/EC(3/1)和1.0 mol/L LiMe在MF/EC(3/1)的电解质在−40 ℃下的离子电导率分别为5.6、8.4和5.4 mS/cm。但是由这类电解质组成的电池容量很低,这是因为MF未参与SEI形成。同样链长较短的MA加入电解液后,容量也衰减较快。相比之下,加入EP(链长更长)的EC/DEC/EP和EC/EMC/EP电解液使电池在300次循环后保持87%~89%的RTC和80%的容量保持率。研究发现,羧酸酯的链长与其形成良好SEI的能力有很大的相关性,随羧酸酯链长或分子量的增加,添加较长链羧酸酯对电解液的离子电导率改善程度减小,但是形成的SEI更好,有助于增强LIB的低温动力学,使电池具有较好的循环性能。
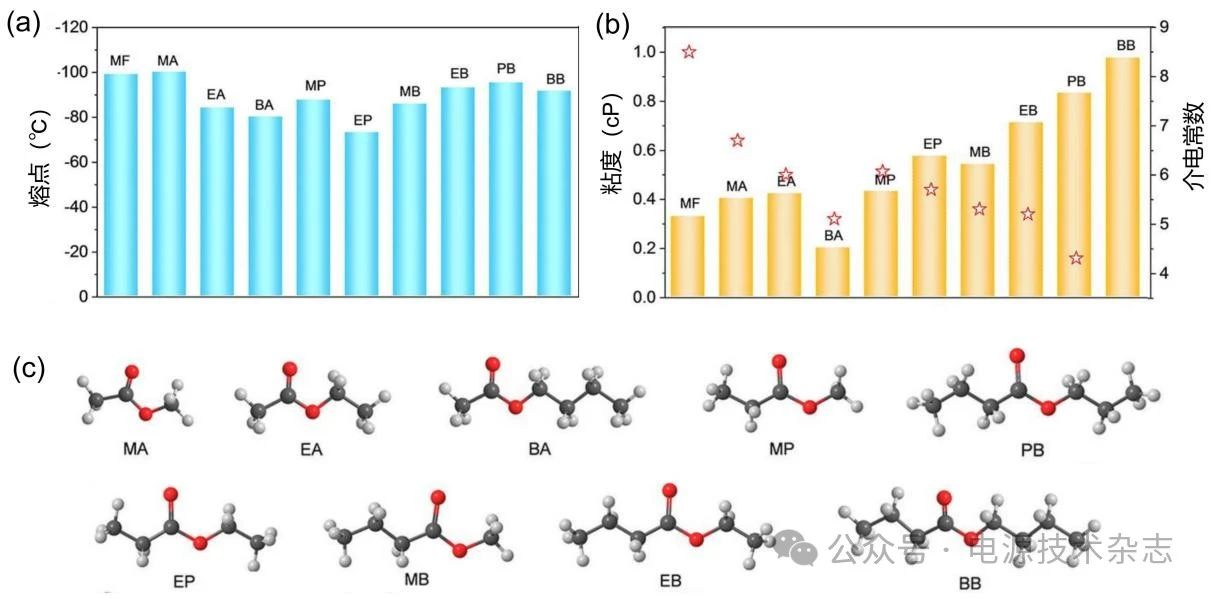
图5 不同羧酸酯溶剂的(a)熔点;(b)粘度和介电常数;(c)溶剂分子结构[9]
短链羧酸酯虽然无法形成有效SEI,维持电池循环稳定性,但是其改善低温下电解液粘度和离子导率的效果十分显著。因此,在保留短链羧酸酯以降低粘度和离子电导率的同时,可以尝试引入添加剂改善其SEI特性。甲苯等碳氢化合物具有良好的成膜能力,有助于改善短链羧酸酯的循环性能。Smart等[18]用1.0 mol/L LiPF6 EC/EMC/X(20∶60∶20,体积比)的组成筛选了多组分电解质的低温性能,其中X=丙酸甲酯(MP)、EP、MB、丁酸乙酯(EB)、丁酸丙酯(PB)、丁酸丁酯(BB)。在0.1 C和−50/−60 ℃下,加入MP和甲苯(tol)的电解液提供的容量是全碳酸基配方的6倍以上。
羧酸酯溶剂的加入可以有效提高电池的低温性能和快充能力,然而当温度升高时,羧酸酯溶剂易分解,对电池循环寿命和效率均会产生较大的影响。使用高浓度盐可以在一定程度上抑制羧酸酯溶剂的分解。另外,采用氟化羧酸酯溶剂可以有效改善其受热易分解的特性,同时还会形成氟化SEI,极大提升电池性能。这在下一节中将会详细讲到。
2.1.3 氟代溶剂
氟代溶剂在锂离子电池电解液中已经有了广泛的应用和研究,目前氟代溶剂被证明能够有效改善电极界面稳定性、拓宽电解液的电压窗口。氟代碳酸酯溶剂也可以作为低温共溶剂,因其熔点较低,抗氧化稳定性好,有利于良好SEI的形成。比如,氟原子取代碳酸乙烯酯(EC)中的一个氢原子,形成电解液中常见的氟代碳酸乙烯酯(FEC)。由于溶剂分子结构和极性的变化,其在电极界面的分解路径会发生改变,得到成分和结构完全不同的SEI,进而影响电池性能。研究表明,未经过氟取代的EC会在锂金属一侧分解产生较多乙烯(C2H4);而FEC分解产生的C2H4较少,且分解产物中含有较多氟化锂(LiF),后者在形成低温稳定SEI时起到重要作用[19]。将碳酸甲乙酯(EMC)进行氟取代形成甲基三氟乙基碳酸酯(FEMC),也可以有效提升溶剂的氧化稳定性,使电池在低温高压的严苛环境中稳定运行[20]。
除了氟代碳酸酯,氟代羧酸酯溶剂也十分有利于提高电池安全性、改善低温性能。研究发现,使用EC/EMC/三氟正丁酸乙酯(TFENB)作为共溶剂的全电池在C/16放电倍率下,可以获得85%的室温容量。其他同样有利于LIB低温性能的氟代羧酸酯还有三氟乙酸甲酯(MTFA)、三氟乙酸乙酯(ETFA)、三氟乙酸正丁酯(NBTFA)和三氟乙酸正己酯(NHTFA)等。
2.2 锂盐
除了优化溶剂之外,还可以通过调换具有不同阴离子的锂盐来调整阴离子在溶剂化结构中的参与度进而影响SEI成分。如图6是几种常用锂盐在最高已占据分子轨道(HOMO)、最低未占据分子轨道(LUMO)、熔点、结构式等方面的差异[9]。LiPF6拥有较好的循环稳定性且价格低廉,是商业电解液中最常用的锂盐,但是LiPF6在循环过程中会分解出HF,钝化Al集流体,导致电池循环过程中的容量衰减[21],并且其在低温下的性能远不如常温。所以需要寻找能够替代LiPF6的锂盐在低温下使用,使电池具有稳定循环和高容量保持率。
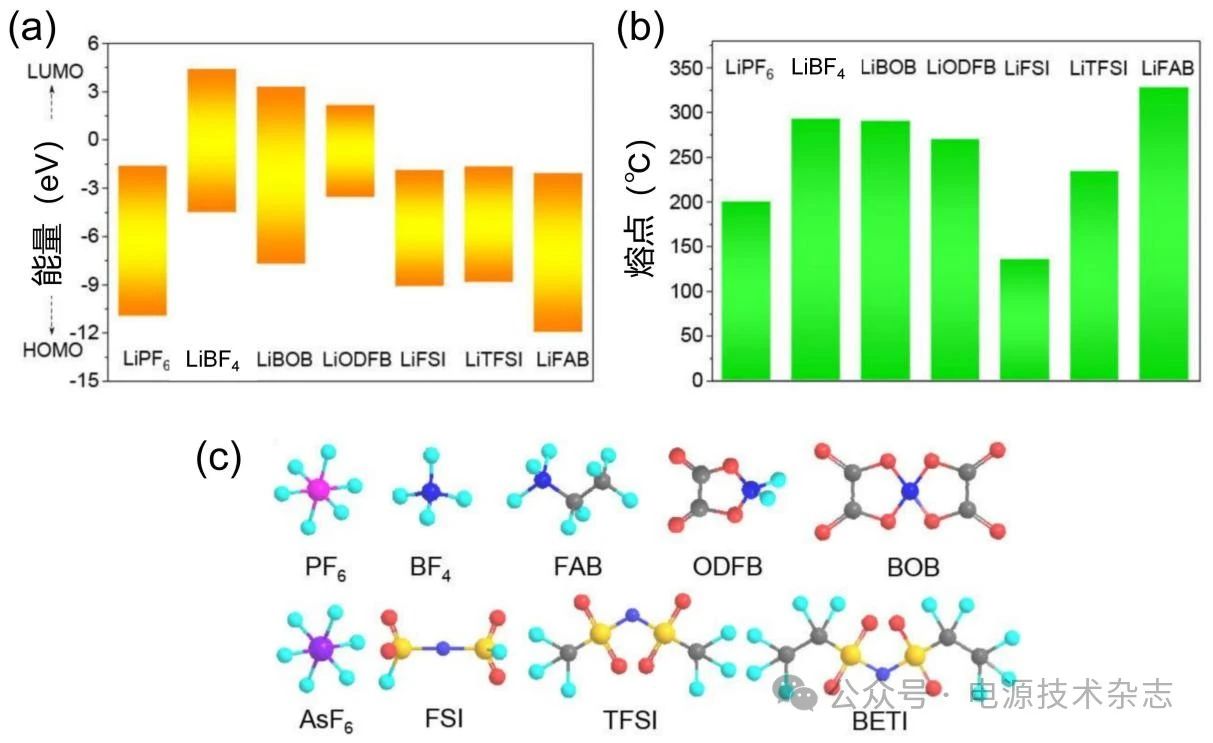
图6 几种常用锂盐的(a)LUMO和HOMO;(b)熔点;(c)分子结构[9]
2.2.1硼盐
有研究发现[22],基于LiBF4的电解质的电导率比LiPF6低2~3倍[图7(a)],但是由于LiBF4在低温下有着较低的电荷转移电阻[图7(c)],其在低温下的放电容量反而高于LiPF6[图7(b、d)]。这表明相较于传统商用锂盐,具有电荷转移动力学优势的锂盐在低温下的可应用性大大增加。
尽管基于LiBF4的电解质在低温LIB中表现出巨大的潜力,但其分解产物易与SEI中的组分发生反应将SEI中的有利组分转变为保护能力较低的不利组分,导致锂离子传输受阻,电池性能下降,阻碍了LiBF4在低温解液中的应用。
LiBF4低温下的电荷转移阻抗低但形成SEI不佳,Zhang等[23]通过引入双(草酸)硼酸锂(LiBOB)改善了SEI的形成,从而有效地提高了石墨在低温下的循环性能。在PC/EC/EMC三元溶剂中使用LiBF4-LiBOB(9:1,摩尔比)盐混合物的电解液在−50至90 ℃的宽温度区间内增强了Li||LFP电池的循环性能和倍率性能[24]。然而LiBOB的粘度较大,依然不是最理想的低温锂盐。
LiDFOB由于其化学结构包含LiBF4和LiBOB各一半的分子结构,因此兼LiBF4和LiBOB的优点,不仅有助于降低低温下的电荷转移阻抗,还能在宽温度范围内保持良好的SEI[25]。在PC/EC/EMC(3/3/4)溶剂中加入LiDFOB的电解液在−30 ℃、0.45 C的低温及高放电倍率条件下仍能显示出67.4%的高室温容量保持率,表明LiDFOB是目前最有前景的低温锂盐。
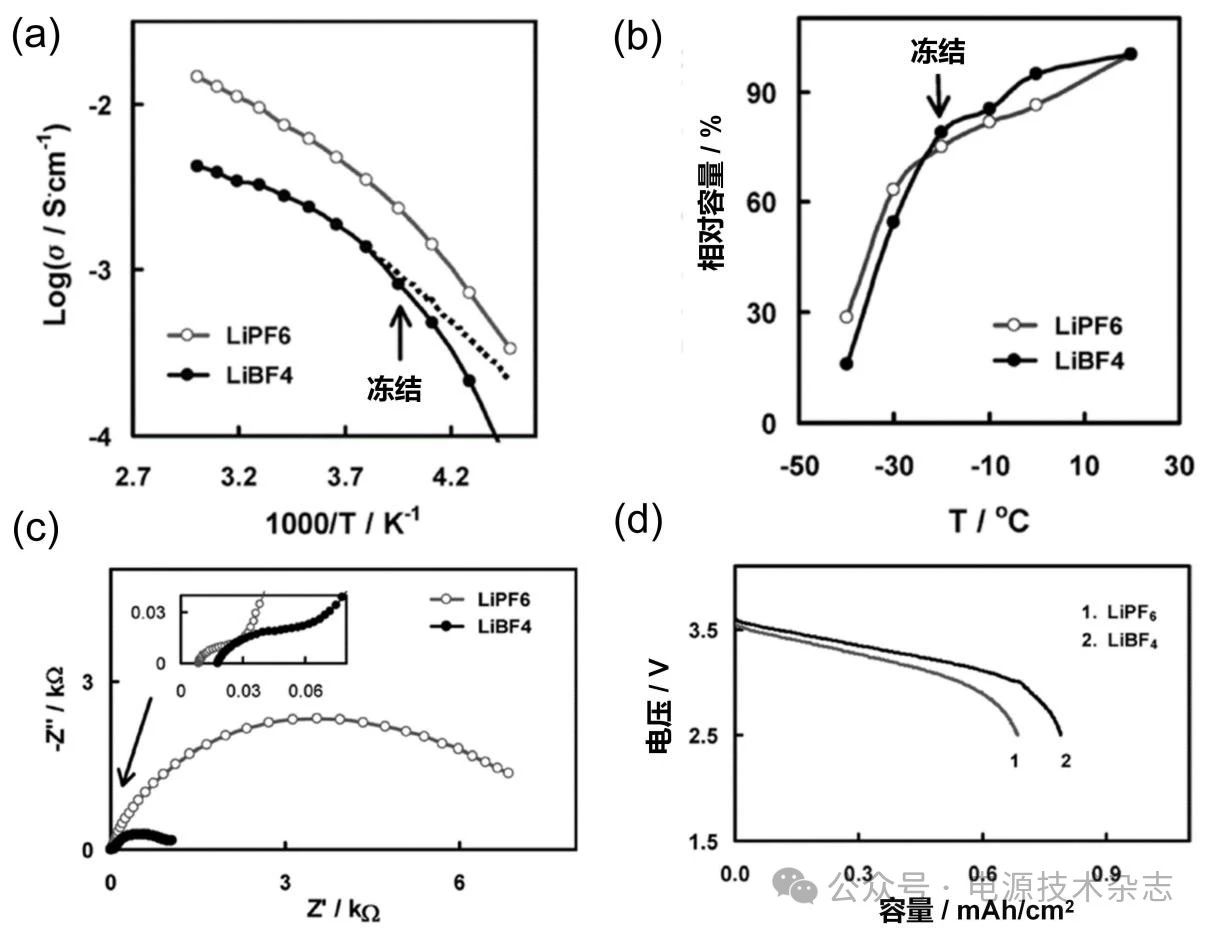
图7 1 mol/L锂盐(LiPF6、LiBF4)在EC/DMC/DEC(1∶1∶1)中的(a)电导率; (b)不同温度下的容量;(c)−20 ℃时的EIS;(d)−20℃放电时的电压-容量曲线[22]
2.2.2 其他锂盐
双(氟磺酰基)亚胺锂(LiFSI)也是低温适用锂盐,因为它能促进富含LiF的SEI的形成,对低温下Li+在SEI中的迁移以及SEI的循环稳定性都有着重要作用。与基于LiPF6的电解质相比,基于LiFSI的电解质(即1.0 mol/L LiFSI DMC/EMC, 3/7)在−5~25 ℃的宽温度范围内具有更高的离子电导率(0.9~6.1 mS/cm)和更高的Li+迁移数(0.5~0.6)。双(三氟甲烷磺酰)亚胺锂(LiTFSI)也因具有较高的热稳定性和较低电极-电解质界面阻抗而备受关注。但是这两个锂盐的阴离子(TFSI−和FSI−)都会腐蚀铝箔,导致电池性能的急剧下降,极大限制了其在低温电解液中的应用[26]。
2.3 添加剂
在电解质中加入少量添加剂是改善电池低温性能最方便、经济的方法,其在电解液中的作用主要集中在电极/电解质界面:(1)协助形成具有高离子导率的SEI;(2)抑制有害的SEI持续生长。
氟代溶剂FEC就是一个经典的添加剂,例如,当采用FEC改性电解液(即1.0 mol/L LiPF6, 4% FEC in EC/EMC/MB)时,−40 ℃下MCMB||LixNiy Co1-yO2全电池可提供73%的室温容量[27]。FEC发挥效用的原理在2.1.3节中也有提到。
此外,含硫溶剂也适合用作添加剂,如DMS的还原产物与锂离子的结合能力较弱,更有利于形成阴离子衍生的SEI。如图8(a)所示,含有质量分数为0.5% DMS的碳酸盐电解质(1 mol/L LiPF6 EC/EMC, 1∶2,质量比)其石墨||NCM523软包电池表现出优异的低温性能,优于商业化的DTD添加剂[28]。
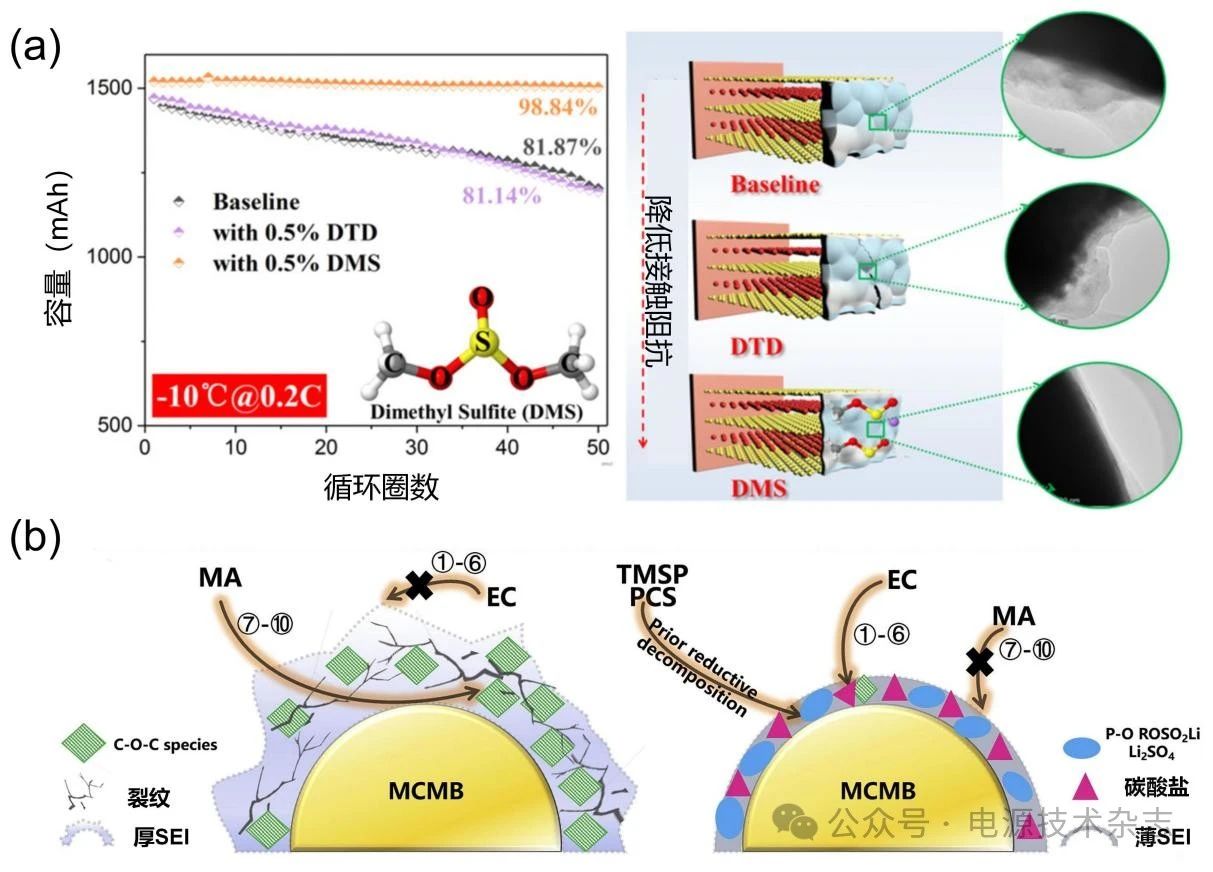
图8 (a)商用电解质[1.0 mol/L LiPF6 EC/EMC, 1∶2(质量比)]分别以DMS和DTD作为添加剂的电解质,其MCMB||NCM811电池的低温循环性能以及相应SEI的差异[28];(b)TMSP和PCS作为功能添加剂的作用机理[29]
烯丙基硫化物(AS) 作为含硫添加剂的重要一员也有较为广泛的应用。添加了AS的电解液被证明在石墨表面自发分解并形成含硫内层SEI,促进了低温下的电荷转移过程,并且AS还能抑制低温下石墨负极表面镀锂,进一步提高LIB的低温性能和安全性能。
Xu等[29]将电解液与MA、三(三甲基硅基)亚磷酸酯(TMSP)和1,3-丙二环硫酸盐(PCS)添加剂混合,使LIB能够在极高压和极宽温域范围内长期运行。由于LUMO轨道能量较低,TMSP和PCS添加剂通过在MCMB负极表面形成离子导电性高、稳定性好的SEI,抑制了MA和碳酸盐溶剂的还原分解[图8(b)]。其他添加剂如碳酸亚乙烯酯(VC)、LiBOB、LiPO2F2也可有效提升LIB的低温性能。
3 总结与展望
随着新能源时代的到来,锂离子电池的应用越来越广泛,高纬度地区新能源汽车的普及使得低温电池的开发需求日益迫切。而电解液作为LIB的血液,相比在外部加热电池这种成本高、收效低且极易发生安全事故的方法,开发低温电解液是最简单也是最经济的思路。本文首先提出了影响LIB低温性能的几大因素包括:(1)本征晶界电阻的增大和电极内Li+的缓慢扩散抑制了锂化反应速率;(2)在低温下负极严重镀锂导致枝晶生长和死锂产生降低电池循环效率;(3)Li+脱溶困难、在SEI中传输缓慢以及电荷转移电阻较大等降低电池动力学;(4)液体电解质粘度增加或低温凝固导致电导率和扩散速率下降,阻碍了离子在电解质中的输运。
随后本文对影响LIB低温性能的因素展开深入探讨,论证了电极/电解液界面处的微观过程是LIB低温性能的决定性因素。Li+在SEI表面的脱溶过程是限制LIB低温应用的决定性步骤。因此,进行电解液的合理调控是改善LIB低温性能更高效更显著的策略,对拓展LIB的低温应用具有重要意义。
设计离子导率高、粘度低、凝固点低以及脱溶能垒小的电解液始终是低温LIB的主要方向和重要目标。最后本文从电解液的三大组成部分(溶剂、锂盐以及添加剂)分别展开论述,总结了不同电解液成分的组合方式对电池性能的影响,为开发更可靠的低温锂离子电池电解质提供了有效指导。



评论